木瓜蛋白酶及其应用

什么是木瓜蛋白酶?
木瓜蛋白酶是一种具有蛋白水解功能的酶,具有半胱氨酸蛋白酶活性,该酶属于超家族,它由单一多肽链组成,含有三个二硫键和一个酶活性所必需的巯基,其来源是绿色的木瓜(图1),木瓜酶的活性取决于果实的绿色。木瓜酶(产品号:P128675等)在所有生物的许多重要功能中具有重要作用[32]。例如对短链多肽、蛋白质、酯化氨基酸和酰胺键具有广泛的蛋白分解功能,在医药和食品原料中具有广泛的功能。它特异性地裂解带正电荷的氨基酸肽链,主要是赖氨酸(产品号:D139442等)、精氨酸(产品号:A118651等)和苯丙氨酸(产品号:Z341221等)残基。
分子量:23,406 Da(氨基酸序列[16],活性最适pH:6.0-7.0;
活性最适温度:65 °C[22],pI:8.75?[17]; 9.55[18]?,光谱特性:λmax:278 nm[19];
消光系数:E1%?= 25[19],EmM?= 57.6 (280 nm)[20]。
抑制剂:E-64(产品号:E109034等)、胱胺二盐酸盐(产品号:C153647等)、胰凝乳蛋白酶抑制剂(产品号:C113165)、依布硒(产品号:E425045等)、亮肽素 三氟乙酸盐(产品号:L332045)
激活剂:半胱氨酸(产品号:D304972等)、重金属螯合剂如EDTA、N-溴代丁二酰亚胺(产品号:B105057)
 单位定义:在25 °C,pH 6.2条件下,一单位每分钟水解1.0 μmole N-α-苯甲酰-L-精氨酸乙酯。
单位定义:在25 °C,pH 6.2条件下,一单位每分钟水解1.0 μmole N-α-苯甲酰-L-精氨酸乙酯。
图1. 分离自绿色番木瓜
特异性
木瓜蛋白酶可消化大部分蛋白底物,比胰蛋白酶(产品号:T274333)范围更广。木瓜蛋白酶具有广泛的特异性,可断裂基础氨基酸,亮氨酸或甘氨酸的肽键。它还能水解脂类和酰胺类化合物。木瓜蛋白酶更倾向于P2位置有大的疏水侧链的氨基酸,它不接受P1'位置的缬氨酸[1]。
溶解度和溶液稳定性
木瓜蛋白酶以10mg / ml溶于水中。使用之前,稀释于含5mM L-半胱氨酸的缓冲液中。它的活化/稳定剂包括EDTA、半胱氨酸和二巯基丙醇[21]。尽管木瓜蛋白酶溶液具有很好的温度稳定性,不过它的稳定性却依赖于pH。在酸性条件下,木瓜蛋白酶溶液并不稳定,例如在pH低于2.8时其活性大幅下降。在溶解状态下,木瓜蛋白酶的活性每天约丧失1-2%,可能是自我分解和/或氧化作用所致。在分离过程中获得的木瓜蛋白酶常见的非活性形式,是蛋白质的活性位点巯基和游离半胱氨酸之间形成的混合二硫化物[23]。木瓜蛋白酶溶液在几种变性剂中也保持稳定,例如经70%甲醇和8M尿素溶液再结晶之后依然保持完整活性。不过,经10%三氯乙酰或6M盐酸胍(产品号:G108673等)处理后木瓜蛋白酶的活性大幅下降。
广泛的应用领域
生命科学行业
1、木瓜蛋白酶广泛应用于细胞分离操作,在某些组织中已被证实比其他蛋白酶效率更高且破坏性更小。例如,木瓜蛋白酶可用于分离有活性的,形态完整的出生后大鼠的皮质神经元[2]。木瓜蛋白酶在分离平滑肌细胞过程中[3,4],能够分离出大量的有活性的平滑肌细胞,并且不影响细胞对刺激剂的敏感性[5]。
2、木瓜蛋白酶的部分水解作用可用于酶和其它蛋白质的结构研究[6-8]。
3、木瓜蛋白酶可应用于红细胞血清学,它通过对红细胞表面的修饰来加强或破坏许多红细胞抗原的反应性,可作为分类、抗体筛选、抗体鉴定的辅助手段。在血小板血清学中,木瓜蛋白酶也有应用[9]。
4、木瓜蛋白酶也可用于氨基酸、肽链和其它分子的酶合成[10-13]。
5、Fab和F(ab')2抗体片段可用于不能出现Fc域的实验系统。在这种情况下,只用抗原结合片段(Fab)更为合适。木瓜蛋白酶可用于常规制备免疫球蛋白G的 Fab片段。免疫球蛋白M也可被木瓜蛋白酶消化,产生大量的同种Fab片段[15]。
木瓜蛋白酶将抗体切割为两个Fab片段(其可变区能够特异性识别抗原),和一个Fc片段[14]。它的切割位置在重链之间二硫键的铰链区之上,重链和轻链中间二硫键位点之下,从而形成了两个分开的Fab片段单价体(各包含单一抗体结合位点),和一个完整的Fc片段。各个片段可用凝胶过滤、离子交换或者亲和层析法来纯化。在淋巴结、脾脏等组织,或是外周血制剂中,含Fc受体的细胞(如巨噬细胞、单核细胞、B淋巴细胞、自然杀伤细胞等)可结合完整抗体的Fc域,导致不含目标抗原的区域也出现背景染色。Fab片段的应用确保了抗体仅结合抗原而非Fc受体。这些片段也可用于血浆存在情况下的细胞染色,因为它们不能结合可溶解细胞的补体。Fab片段的应用使得目标抗原定位更精准,例如在电子显微镜的组织染色中(图2)。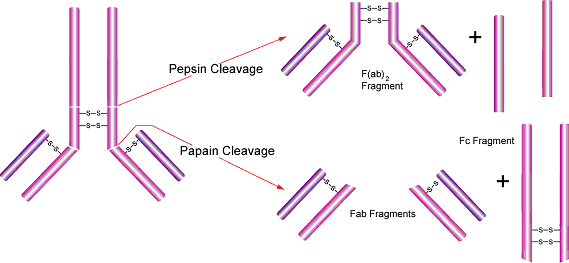
图2.?胃蛋白酶和木瓜蛋白酶切割
医疗保健行业
木瓜酶支持治疗肿瘤的免疫系统,因为它控制和改变免疫反应中的白细胞。关节和前列腺的肿胀和红肿减轻[24]。来自生木瓜的木瓜酶显示出90%的活性。2012年,Hitesch等人通过结块形成和吸光度测定的方法研究了这种酶的作用。得到了对细胞系统有危险作用的盐酸药物左乙拉西坦和颗粒剂的酶降解化合物。对药物进行了分光光度和薄层分析,结果显示效果良好[25]。木瓜酶还具有抗真菌的特性。2010年,Chukwuemka和Anthony报道了番木瓜可以减少引起番木瓜腐烂的真菌感染,调查了从根霉、曲霉和粘液中获得的不同真菌,发现了减少菌丝的抑制带,并从统计学上检验了使用番木瓜可以延长木瓜的货架期[26]。木瓜酶可降低渗漏类消化不良综合征的过敏反应,减少盐酸,降低对明胶的耐受性。它被证明对无副作用的头部和牙齿疼痛过敏有显著的止痛和消炎作用[27]。它在皮肤和伤口护理中具有至关重要的作用,夏威夷和塔希提利用从木瓜中提取的浓缩部分木瓜酶来治疗皮肤伤口、灼伤、床疮、刺激和皮疹,并被证明是成功的。2012年,Detrich使用木瓜蛋白酶治疗运动损伤和运动足,3-8天是使用木瓜蛋白酶后的恢复时间[28]。
食品工业
在世界范围内,木瓜酶是食品工业中研究较多、最常用的一种酶。木瓜酶用于嫩化肉类蛋白,尤其是肌原纤维和结缔组织。用不同浓度的木瓜酶(0.25%、0.05%、0.075%、0.1%)处理5%或3%水平的母鸡腿部切块,以改善肉质嫩度。浓度为0.25%的木瓜蛋白酶在3%的水平上显示出明显的嫩度比0%的对照组要高。采用注射倍数和分叉加浸泡技术进行肉切,本研究采用0.25%的木瓜酶配合分叉+浸泡的方法对废鸡肉进行嫩化处理,改善其功能特性,以达到有效利用的目的[29]。木瓜酶在食品工业中具有重要的澄清剂作用。因为它能分解蛋白质,因此可以消化它,并在控制消化不良和其他消化系统和胃肠道疾病方面发挥重要作用[30]。研究表明,木瓜酶通过作用于酪蛋白的交联作用,改善了纳布尔西干酪在不同糕点、披萨和库纳法干酪中的熔融性和延伸性。木瓜酶处理的纳布尔西干酪具有良好的纤维结构,在比萨和糕点的使用中表现出良好的效果和良好的储藏性能,导致了高盐导致的熔融或伸长,是一种有效的方法。木瓜酶被用在可以咀嚼的口香糖中作为柔软剂[31]。
总结
本文对木瓜蛋白酶的基本结构、作用机理、生产及工业应用进行了综述。木瓜酶是目前市场上应用最广泛的水解酶之一,具有很好的市场前景。通过重组DNA和固定化技术,木瓜酶有望成为工业化应用的理想材料。研究人员可以通过了解木瓜酶的详细机制和功能来探索更有效的应用。然后,将会有新的木瓜酶功能,满足人们对改善生活的巨大需求。
参考文献
1.?GP Moss.?[Internet].?EC 3.4.22.2:?International Union of Biochemistry and Molecular Biology (IUBMB).[updated 05 Jun 2020; cited 17 Jul 2020].?Available from:?https://www.qmul.ac.uk/sbcs/iubmb/enzyme/EC3/4/22/2
2.?Huettner?J,?Baughman?R.?1986.?Primary culture of identified neurons from the visual cortex of postnatal rats.?J. Neurosci..?6(10):3044-3060.?https://doi.org/10.1523/jneurosci.06-10-03044.1986
3.?Kinoshita?K,?Sato?K,?Hori?M,?Ozaki?H,?Karaki?H.?2003.?Decrease in activity of smooth muscle L-type Ca2+ channels and its reversal by NF-?B inhibitors in Crohn's colitis model.?American Journal of Physiology-Gastrointestinal and Liver Physiology.?285(3):G483-G493.?https://doi.org/10.1152/ajpgi.00038.2003
4.?Driska?SP,?Laudadio?RE,?Wolfson?MR,?Shaffer?TH.?1999.?A method for isolating adult and neonatal airway smooth muscle cells and measuring shortening velocity.?Journal of Applied Physiology.?86(1):427-435.?https://doi.org/10.1152/jappl.1999.86.1.427
5.?HASEGAWA?M,?KOBAYASHI?M,?OYAMADA?H,?KAMISHIMA?T,?YOSHIDA?C,?OHATA?H,?MARUYAMA?I,?MOMOSE?K,?GOMI?Y.?1987.?Studies on isolated smooth muscle cells.IX Application of papain for isolation of single smooth muscle cells from guinea-pig taenia coli..?Jpn.J. Smooth Muscle Res..?23(1):35-46.?https://doi.org/10.1540/jsmr1965.23.35
6.?Margossian?SS,?Lowey?S.?1973.?Substructure of the myosin molecule.?Journal of Molecular Biology.?74(3):301-311.?https://doi.org/10.1016/0022-2836(73)90375-6
7.?Margossian?SS,?Lowey?S.?1973.?Substructure of the myosin molecule.?Journal of Molecular Biology.?74(3):313-330.?https://doi.org/10.1016/0022-2836(73)90376-8
8.?Shiozaki?K,?Yanagida?M.?1991.?A functional 125-kDa core polypeptide of fission yeast DNA topoisomerase II..?Mol.Cell.Biol..?11(12):6093-6102.?https://doi.org/10.1128/mcb.11.12.6093
9.?Kyer?CI.?1995.?Information technology law: What does the future hold?.?Computer Law & Security Review.?11(3):140-142.?https://doi.org/10.1016/s0267-3649(00)80035-7
10.??-Nitro-?-amino acids as latent ?,?-dehydro-?-amino acid residues in solid-phase peptide synthesis.?2004(10):101.?https://doi.org/10.3998/ark.5550190.0005.a11
11.?Rajesh?M,?Kapila?S,?Nam?P,?Forciniti?D,?Lorbert?S,?Schasteen?C.?2003.?Enzymatic Synthesis and Characterization ofl-Methionine and 2-Hydroxy-4-(methylthio)butanoic Acid (HMB) Co-oligomers.?J. Agric. Food Chem..?51(9):2461-2467.?https://doi.org/10.1021/jf026093g
12.?Fukuoka?T,?Tachibana?Y,?Tonami?H,?Uyama?H,?Kobayashi?S.?2002.?Enzymatic Polymerization of Tyrosine Derivatives.Peroxidase- and Protease-Catalyzed Synthesis of Poly(tyrosine)s with Different Structures.?Biomacromolecules.?3(4):768-774.?https://doi.org/10.1021/bm020016c
13.?Burton?SG,?Cowan?DA,?Woodley?JM.?2002.?The search for the ideal biocatalyst.?Nat Biotechnol.?20(1):37-45.?https://doi.org/10.1038/nbt0102-37
14.?Greenfield?E.?2014.?Antibodies: A Laboratory Manual.?2.?New York:?Cold Spring Harbor Laboratory Press.
15.?NEWKIRK?MM,?EDMUNDSON?A,?WISTAR?R,?KLAPPER?DG,?CAPRA?JD.?1987.?A New Protocol to Digest Human IgM with Papain that Results in Homogeneous Fab Preparations that Can Be Routinely Crystallized.?Hybridoma.?6(5):453-460.?https://doi.org/10.1089/hyb.1987.6.453
16.?Mitchel?R,?Chaiken?I,?Smith?E.?1970.?The Complete Amino Acid Sequence of Papain.?J. Biol. Chem.?2453485-3492.?https://www.jbc.org/article/S0021-9258(18)62954-0/pdf
17.?Smith?EL,?Kimmel?JR,?Brown?DM.?1954.?CRYSTALLINE PAPAIN: II.PHYSICAL STUDIES; THE MERCURY COMPLEX.?J. Biol. Chem..?207533-549.?https://doi.org/10.1016/S0021-9258(18)65670-4
18.?Sluyterman?L,?de Graaf?M.?1972.?The effect of salts upon the pH dependence of the activity of papain and succinyl-papain.?Biochimica et Biophysica Acta (BBA) - Enzymology.?258(2):554-561.?https://doi.org/10.1016/0005-2744(72)90247-1
19.?Glazer?AN,?Smith?EL.?1961.?Phenolic Hydroxyl Ionization in Papain.?J. Biol. Chem..?2362948-51.
20.?Pace?CN,?Vajdos?F,?Fee?L,?Grimsley?G,?Gray?T.?1995.?How to measure and predict the molar absorption coefficient of a protein.?Protein Sci..?4(11):2411-2423.?https://doi.org/10.1002/pro.5560041120
21.?Arnon?R.?1970.?[14] Papain.226-244.?https://doi.org/10.1016/0076-6879(70)19017-3
22.?Kilara?A,?Shahani?KM,?Wagner?FW.?1977.?Preparation and properties of immobilized papain and lipase.?Biotechnol.Bioeng..?19(11):1703-1714.?https://doi.org/10.1002/bit.260191109
23.?Klein?IB,?Kirsch?JF.?1969.?The Activation of Papain and the Inhibition of the Active Enzyme by Carbonyl Reagents.?J. Biol. Chem..?2445928-5935.https://www.jbc.org/article/S0021-9258(18)63561-6/fulltext
24.?Krishna KL, Paridhavi M, Patel JA 2008 Biochemistry?32 123.
25.?Hitesh P, Manojbhai BN, Mayuri BA, Kiranben DV 2012 Int. J. Pharm.Biol. Sci.?2 113-115.
26.?Chukwuemeka O, Anthonia AB 2012 Afri. J. Agric. Res. 5 1531-1535.
27.?Mansfield LE, Ting S, Harverly RW, Too TJ 2010 Annals of Allergy?55 541-543.
28.?Diettrich RE 2012 Pa. Med. 68 35.
29.?Khanna N, Panda PC 2007 Indian J. Anim. Res. 41 55-58.
30.?Huet J, Bartik Y, Raussns V, Wintjens R, Boussard P 2006 Biochem. Biophys. Res. Commun.?341 620-626.
31.?Hejazin RK, EI- Qudah M 2009 Am. J. Agri. Biol. Sci. 4 173-178.
32.?Tsuge H, Nishimura T, Tada Y, Asao T, Turk D, Turk V, Katunuma N 2012 Biochem. Biophys. Res. Commun. 266 411-416.
 首页
首页 400-620-6333
400-620-6333



 危险品化学品经营许可证(带存储)
危险品化学品经营许可证(带存储)